GIST – från operation till tyrosinkinashämmare
2015-02-04 / Svensk Kirurgi / Volym 73 / Nr 6 / 2015
Med kännedom om tumörbiologi kan nya behandlingsmetoder komma patienten till nytta. Ett exempel på detta är utvecklingen av GIST-behandling, ämnet för Sandström-föreläsningen vid Kirurgveckan i Örebro 2015. Bengt Nilsson, Sahlgrenska akademin beskrev historik, verkningsmekanismer för läkemedelsbehandling och framtida möjliga targets för behandling av denna tumörform, som tidigare endast var tillgänglig för kirurgi. Som så ofta är de nya behandlingarna mycket dyra och ställer nya krav på nytta–vintsberäkningar.

Hella Hultin
hella.hultin@surgsci.uu.se
Uppsala
GIST är den vanligaste mesenkymala tumören i magtarmkanalen och förekommer oftast i magsäck och tunntarm (53 respektive 32%), men kan även finnas i andra delar av gastrointestinalkanalen, samt i oment och retroperitoneum. Medianåldern för insjuknande är 67 år och det finns ingen könsskillnad. Incidensen är 15/miljon/år och prevalensen 130/ miljon/år. De flesta GIST upptäcks kliniskt som palpabel tumör eller på grund av blödning, men fynd vid CT eller endoskopi förekommer också. Metastasering sker vanligen till lever och inom bukhålan, endast i sällsynta fall till lymfkörtlar och extraabdominellt. Diagnosen ställs med hjälp av CT, MR, finnålsbiopsi, mellannål med mutationsanalys och/eller endoskopiskt ultraljud med mellannålsbiopsi.
Bakgrund
Bengt Nilsson inledde med en kort historisk tillbakablick och berättade om Santiago Ramon y Cajal som tillsammans med Camillo Golgi fick nobelpriset i medicin 1906, för sina anatomiska fynd inom nervsystemet. Han hade funnit Interstitial Cells of Cajal (ICC ), de neuronlika spolformade cellerna i tarmväggen som ibland kallas för tarmens pacemakerceller, då de ger upphov till tarmens peristaltik. Normal funktion av ICC förutsätter en typ III-tyrosinkinasreceptor. Upptäckten av onkgenen KIT, som kodar för denna tyrosinkinasreceptor, ledde sedan till upptäckten att KIT också är starkt uttryckt i GIST. Detta kunde visas av patologen L-G Kindblom i Göteborg 1998, och utgör ett pionjärarbete inom GIST-området. Idag är det vedertaget att GIST-tumörer härstammar från samma stamcell som ICC. Nyare studier har påvisat höga halter av synaptiska vesikelproteiner såsom SV2, VIP, CCK och Ghrelin i GIST, vilket gör att den kan sägas ha vissa neuroendokrina drag. Dessutom finns hos vissa GIST (wild type) ett uttryck av somatostatinreceptorer, framför allt SSRT1, vilket gör den synlig på Octreoscan.
KIT
KIT, den viktigaste receptorn hos GIST, är en transmembranös tyrosinkinasreceptor med en extracellulär bindningsregion för sin ligand SCF (stem cell factor). Den intracellulära delen har två tyrosinkinasregioner samt ett bindningsställe för ATP. KIT-proteinet aktiveras genom att SCF binds varefter två KIT slås samman genom homodimerisering. KIT är avgörande för normal utveckling av flera olika cellsystem, bland annat mastceller, melanocyter, könsceller, hematopoetiska celler och inte minst ICC. KIT uttrycks även i andra tumörer, till exempel i angiosarkom, Ewing’s sarkom, brösttumörer, melanom, småcellig lungcancer och seminom.
Homodimeriseringen resulterar i fosforylering och aktivering av tyrosinkinas. Substrat binds och aktiverar cellsignaleringskaskader som reglerar viktiga cellfunktioner såsom proliferation, adhesion, apoptos och celldifferentiering.
Ytterligare banbrytande arbete inom GIST-forskningen kom i slutet av 90-talet när Hirota et al kunde visa mutationer i KIT, som ledde till ligand-oberoende aktivering, så kallad gain-of-function mutation. Detta innebär okontrollerad proliferation och upphävd apoptos. De hade funnit exon elva mutationer i fem av sex tumörer. Senare studier har visat att mutationer också förekommer i exon 9, 13 och 17 hos GIST, samt även i PDGFRA (exon 12 och 18) men att dessa är mindre vanliga.
Imatinib
Fram till dess hade operation varit enda behandlingsmetoden, men nu utvecklades tyrosinkinashämmare som en medicinsk behandlingsmöjlighet. Imatinib (Glivec) som syntetiserades 1992 och som till en början var tänkt som hämmare av PDGFR visade sig vara mycket effektiv mot aktiverad KIT-receptor. Imatinib registrerades för behandling av GIST 2002.
Imatinib är en effektiv behandling vid både KML och GIST och verkar specifikt genom att blockera ATP fickan i tyrosinkinas 1 (= exon 13) och förhindrar på så vis kinaset att överföra fosfatgrupper från ATP till tyrosinsubstrat. Detta leder till hämning av nedströms signalering vilket i sin tur leder till minskad cellproliferation och aktivering av apoptos.
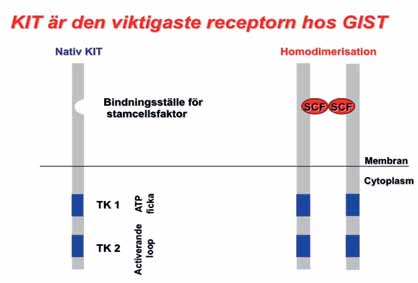
KIT är en transmembranös tyrosinkinasreceptor. Den extracellulära regionen har ett bindningsställe för sin ligand SCF (stem cell factor). Den intracellulära regionen består av två tyrosinkinasregioner med en ATP-ficka. När SCF binds aktiveras KIT och två närliggande receptorer binds samman genom homodimerisering.
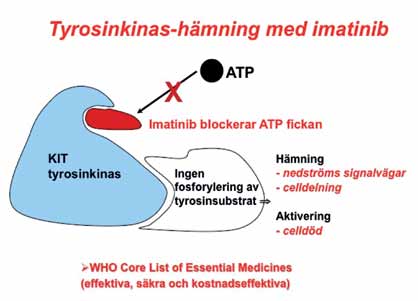
Imatinib verkar specifikt genom att blockera ATP-fickan i TK 1 och förhindrar därmed fosforylering. Härav hämmas nedströms signalering vilket i sin tur leder till minskad cellproliferation och aktivering av apoptos.
Riskskattning vid GIST
Sedan 2002 riskskattas GIST enligt en algoritm utifrån antal mitoser och tumörstorlek. I en Göteborgsstudie har ytterligare faktorer testats på ett populationsmateriel bestående av 288 tumörer. Multivariat analys visade att endast tumörstorlek och Ki67max% var oberoende faktorer för överlevnad. Baserat på detta utarbetades en risk score som innefattade tumörstorlek och Ki67max% med formeln 0,0486 x tumörstorlek + 0,0491 x Ki67 max%.
Bild 3 visar sannolikheten för död av GIST inom fem år. Vid Risk score <7 skilde sig inte överlevnaden från normalpopulationens. Senare studier har visat att patienter med lågrisktumörer, som kan opereras radikalt, mår mycket bra och sällan recidiverar. I sådana fall finns ingen indikation för adjuvant behandling.
Risk score > 7 är associerat med ökad risk för död inom fem år, och man ser en snabbt ökande risk med stigande score. Här bör man överväga adjuvant behandling. Ett problem med behandlingen är den höga kostnaden för läkemedlet. Sahlgrenska har utarbetat en metod för att beräkna behandlingsvinsten som en produkt av livskvalitet och förväntad levnadstid, quality adjusted life years, QUALY. En QUALY = ett perfekt hälsoår, noll QUALY = död. Om QUALY är > 0,5 kan adjuvant behandling försvaras.
Imatinibresistens
Resistensutveckling är ett annat problem. Cirka tio procent av patienterna svarar inte alls på Imatinibbehandlingen (primär resistens) och cirka 40 procent utvecklar sekundär resistens under pågående behandling – sannolikt beroende på utveckling av sekundära mutationer. Till gruppen med primär resistens hör exempelvis patienter med KIT-mutation i exon 9. Vissa av dessa kan dock få bra resultat av behandlingen med en dubblering av imatinibdosen.
Neoadjuvant Imatinib
Imatinib kan också användas neoadjuvant med framgång. En kraftig tumörregress kan åstadkommas, som ger möjlighet till enklare, organsparande kirurgi, som sparar ex cardia, pankreas eller rektum.
Framtiden
Bengt Nilsson avslutade med att berätta om de senast utvecklade andra och tredje generationens TKhämmare. Sunitinib (Sutent), regorafinib (Stivarga), sorafenib (Nexavar), pazopanib (Votrient) och vandetanib (Caprelsa) som har varierande verkningsmekanismer och därför är framgångsrika beroende av var den aktuella mutationen finns. De har en varierande biverkningsprofil, men som gemensamt för alla dessa läkemedel är att de är förenade med höga kostnader. Flera andra behandlingsmetoder, såsom till exempel radioterapi med isotop fäst till somatostatinreceptor 1 (pågående utveckling vid Sahlgrenska), Heat Shock protein 90 hämmare, mTOR-hämmare eller stamcellshämmare kan bli framtida alternativ för patienter med behandlingsresistens. Dessutom finns det många olika kombinationsmöjligheter av kända behandlingar att tillgripa. Leverartärembolisering/RF-behandling av levermetastaser kan prövas. Vid recidiv då inte TKI längre har effekt kan man alltid överväga ny kirurgi.
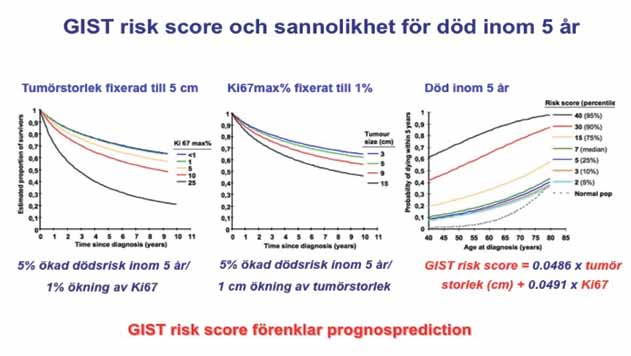
Multivariat analys visade att endast tumörstorlek och Ki67max% utgjorde oberoende faktorer för overall survival.
