Prisbelönad forskning Stora Forskarpriset 2015 till Sara Regnér
2015-09-29 / Svensk Kirurgi / Volym 73 / Nr 4 / 2015
Utvald bland många starka kandidater belönades i år Sara Regnér med Stora Forskarpriset à 250000 kronor. Vi har i detta nummer glädjen att ta del av hennes forskning, från studie av biomarkörer vid pankreatit till djurmodeller och genuttryck, allt sprunget ur kliniska frågeställningar och med syfte att hjälpa patienter. Vi får också en fin beskrivning av hur forskarintresse kan väckas och fortsätta växa i en kreativ miljö.

Sara Regnér
sara.regner@med.lu.se
Malmö
Jag stod i matbutiken när Ulf Gunnarsson ringde och berättade att jag tilldelats Svensk Kirurgisk Förenings Stora Forskarpris. Jag blev så klart både överraskad och mycket glad! Inte minst med tanke på de övriga nominerade; Martin Rutegård, Kevin Mani, Jon Tsai, Pär Myrelid och Ville Wallenius, kände jag mig oerhört stolt och hedrad över att jag tilldelats priset. Jag vill rikta ett stort tack till Svensk Kirurgisk Förening och Kommittén för klinisk forskning som valt att tilldela mig detta pris och självklart även tacka Johnson och Johnson som gör detta möjligt. Jag tycker att det är fantastiskt roligt att min forskning uppmärksammas och att pankreasforskning i Sverige lyfts fram på detta sätt.
Jag är uppvuxen i Höllviken, söder om Malmö, och har läst medicin i Lund med kliniska placeringar förlagda till Malmö. Redan under utbildningen kom jag i kontakt med professor Anders Borgström som med sin moderna syn på pedagogik säkert bidrog till att jag redan då fastnade för kirurgi. Kirurgkliniken i Malmö präglades av en god kollegial stämning och en god utbildningssituation. Redan efter kirurgkursen påbörjade jag ett mindre forskningsprojekt inom bröstcancer. Under utbildningen hann jag också med ett par underläkarvikariat på kirurgkliniken i Ålesund, Norge. Efter avslutad AT-tjänstgöring i Hässleholm/ Kristianstad återvände jag till Malmö där jag gjorde min ST och blev specialist i kirurgi 2006. Relativt snart efter återkomsten till Malmö bytte jag forskningsområde till det som skulle prägla min fortsatta yrkesbananämligen pankreas – the golden gland. Under Anders Borgströms handledning fick jag utrymme för min kreativitet och nyfikenhet. Jag fick möjlighet att skapa och testa egna hypoteser, att utföra laboratoriearbete samt att sätta upp och genomdriva kliniska studier. Mina studier fokuserade på biomarkörer för svår akut pankreatit. Jag fick möjlighet att karakterisera ett proteas (aktivt Carboxypeptidas B) och att jämföra nivåer av proteaser och inflammatoriska biomarkörer över tid för att bättre försöka förstå patofysiologin som leder till svår akut pankreatit. Studierna baserades på resultat från eget laboratoriearbete. Det var Anders’ laboratorieingenjör, Anne-Marie Rohrstock, som lärde upp mig så att jag själv kunde utföra de metoder jag behövde. Anne-Marie var också ett ovärderligt stöd efter Anders alltför tidiga bortgång 2007. Med hjälp av min nästa handledare, Professor Jonas Manjer, kunde jag slutföra mitt avhandlingsarbete som det var tänkt och disputera 2008 med avhandlingen Protease Activation and Inflammation in Acute Pancreatitis. Jonas lärde mig nästan allt jag kan om epidemiologi och statistik och han är fortfarande en nära samarbetspartner, vän och kollega som jag uppskattar mycket. Tack vare Jonas blev slutfasen av mitt avhandlingsarbete en positiv, konstruktiv och givande tid som haft stor betydelse för min fortsatta utveckling som forskare. Jag hoppas verkligen att Jonas (som för övrigt fick Svensk Kirurgisk Förenings Stora Forskarpris 2012) tar åt sig lite av äran att jag, som var hans första doktorand, får denna fina utmärkelse i år.
Egen forskargrupp
Djur- och cellmodeller
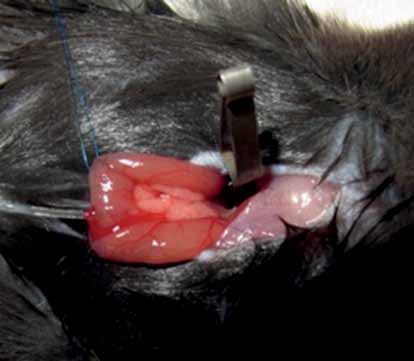
Bild 1. Taurocholat injiceras i pankreasgången på mus via en plastkateter. En klämma på duktus hepaticus communis förhindrar intrahepatisk infusion. Operationen sker på en sövd mus med hjälp av ett mikroskop.
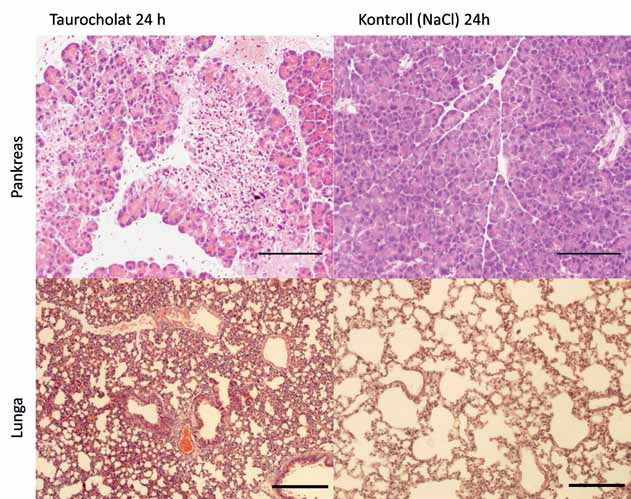
Bild 2. Överst visas pankreasvävnad från en mus med taurocholatinducerad pankreatit till vänster och från en kontrollbehandlad mus till höger. Nederst visas lungvävnad från en mus med taurocholatinducerad pankreatit till vänster och från en kontrollbehandlad mus till höger.
Kliniska studier
En viktig och övergripande hypotes i min forskning är att de biomarkörer vars nivåer skiljer sig mellan patienter med svår, medelsvår och mild pankreatit representerar de processer där en behandling skulle kunna vara värdefull. I kliniska studier undersöker vi således olika biomarkörer. Detta är givetvis av stort värde för att vi som kliniker behöver hjälpmedel för att tidigt identifiera de patienter som kommer att utveckla en svår akut pankreatit. Tidig adekvat vätskebehandling och tidig identifikation och behandling av sviktande organsystem har visats förbättra prognosen för patienter med akut pankreatit. I dagens ansträngda sjukvårdssituation hade det också varit av stort värde att tidigt kunna identifiera en adekvat vårdnivå för dessa patienter, kanske till och med en viss patientgrupp skulle kunna polikliniseras förutsatt att vi som kliniker har pålitliga hjälpmedel för att prognosticera sjukdomen. Ett problem med forskningen runt biomarkörer för akut pankreatit har varit att definitionerna av svår och mild akut pankreatit har varit vaga. Med den nya Atlantaklassifikationen från 2012 har definitionerna blivit tydligare, vilket underlättar forskningen. Den nya indelningen med mild, medelsvår och svår akut pankreatit representerar bättre det kliniska panoramat. Förhoppningsvis kommer biomarkörer att vara ett värdefullt verktyg för oss kliniker i framtiden.
Translationellt syfte
Ytterligare ett viktigt syfte med de kliniska studierna är att förstå hur biomarkörer förändras över tid eftersom detta speglar de patofysiologiska processerna. Avsaknaden av en specifik behandling för akut pankreatit kan till stor del tillskrivas bristande insikter i patofysiologin. Vi behöver dels förstå vilka mekanismer som är viktiga för sjukdomsutvecklingen och dels när i förloppet dessa mekanismer har betydelse. Vi kan då förstå när i tidsförloppet en specifik behandling kan förväntas ha effekt och även ha lättare att finna nyckelmolekyler som kan påverka de viktiga processerna. När intressanta biomarkörer identifieras i kliniska studier kan de patofysiologiska processer de representerar undersökas i djur- och cellmodeller. Omvänt kan markörer för intressanta processer vi undersökt i djurmodeller sedan undersökas i blod från patienter med syfte att bättre kunna överföra resultat från djurdata till kliniken.
Trypsinogenaktivering och inflammation
Vi har, i flera arbeten, beskrivit sambandet mellan trypsinogenaktivering och inflammation(1-3). Vi fann bland annat att trypsinogenaktivering sker bifasiskt. Den första aktiveringen sker direkt, i initieringen av sjukdomen, medan den andra aktiveringstoppen orsakas av det inflammatoriska svaret. Båda dessa toppar ligger emellertid ganska tidigt i sjukdomsförloppet, sannolikt alltför tidigt för att kunna påverkas av farmaka i en klinisk situation. Vi har kunnat visa att effekterna av taurocholat på pankreas, lungor och blod kan mildras avsevärt om de neutrofila granulocyterna förhindras att ta sig in i pankreas(2,3). Med intravitalmikroskopi (bild 3) har vi undersökt hur de neutrofila granulocyterna tar sig från de postkapillära venolerna och in i pankreasvävnaden och vilka molekyler som är viktiga för denna neutrofilmigration. Den positiva effekten, med mildare sjukdomsbild och mindre vävnadsskada, är likartad oavsett om neutrofilerna slås ut helt eller om de hindras att ta sig in i pankreas genom blockering av nyckelmolekyler som till exempel P-selektin. Bäst effekt får man emellertid även här om neutrofilmigrationen blockeras innan sjukdomen initieras. För att bättre förstå vad som händer och komma närmare en potentiell behandling har vi tittat på både vad som styr de neutrofila granulocyterna och vad de orsakar senare i sjukdomsförloppet. En intressant upptäckt är att trombocyter bidrar starkt till inflammationen, bland annat genom att reglera migration av neutrofila granulocyter till pankreas.
Reglering av genuttryck
Neutrofiler styrs, liksom andra leukocyter, av signalsubstanser som cytokiner och kemokiner. Vi har undersökt vilka kemokiner som är viktiga vid akut pankreatit och hur dessa regleras. Extracellulär stress kan påverka intracellulära processer via transmembranreceptorer. Vid akut pankreatit har vi visat att Toll like receptor 4 är viktig för att inflammationen ska spridas. Via aktivering/inaktivering styrs sedan intracellulära processer som bidrar till att DNA för specifika cytokiner och kemokiner transkriberas och att dessa proteiner sedan syntetiseras. Vi har funnit att Nuclear Factor of Acitvated T-cells, NFAT, verkar ha en viktig roll i hur de proinflammatoriska proteinerna transkriberas vid svår akut pankreatit4 . Vi har även funnit att histondeacetylaser, som används vid vissa onkologiska sjukdomar, reglerar genuttryck även vid pankreatit och att inhibering dessa verkar kunna mildra sjukdomen avsevärt(5).
Neutrofil extracellular traps
I en ännu opublicerad studie visar vi hur neutrofila granulocyter bildar extracellulära nätstrukturer så kalllade neutrophil extracellular traps, NETs, vid svår akut pankreatit. Själva nätet består av extracellulärt DNA och histoner med ursprung från neutrofilernas cellkärnor (bild 4). Nätet är beklätt med granulaenzymer som leukocytelastas och myeloperoxidas. NETs har vid andra sjukdomar visats kunna eliminera bakterier, och beskrivs som en ny mekanism i immunförsvaret. Man har också sett en protrombotisk effekt av NETs. Detta är synnerligen intressant för patofysiologin vid akut pankreatit där koagulopatins roll är relativt outforskad. Vi vet att ischemi kan utlösa pankreatit och att fokal ischemi kan ge upphov till nekrosbildning. Vid svår pankreatit ses ibland mikrotrombi i pankreas. Likaså har nivåer av D-dimer visats vara förhöjda tidigt hos patienter som senare utvecklar en svår akut pankreatit, vilket talar för att det är av betydelse för sjukdomens utveckling. När vi i försök eliminerat NETs med DNAse, minskade vävnadskadan i såväl pankreas som lungor på möss där taurocholat injicerats i pankreasgången. Likaså minskade den generella inflammationen och inflammatoriska markörer i blodet när NETs eliminerats. Dessutom har vi i blodprover från patienter med svår akut pankreatit uppmätt höga nivåer av markörer för NETs som extracellulärt DNA och histon/ myeloperoxidas komplex, vilket talar för att dessa nätstrukturer spelar en viktig roll även vid human svår akut pankreatit.
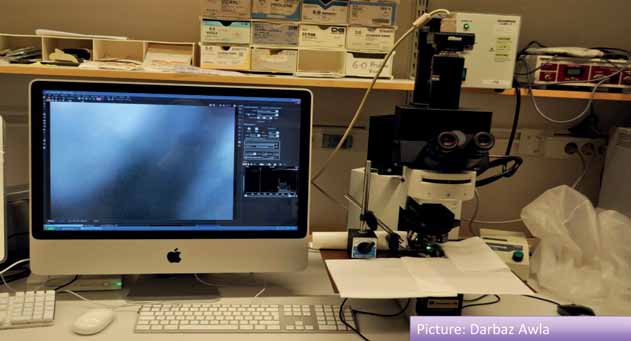
Bild 3. Apparatur för intravitalmikroskopi av pankreas på sövd mus.
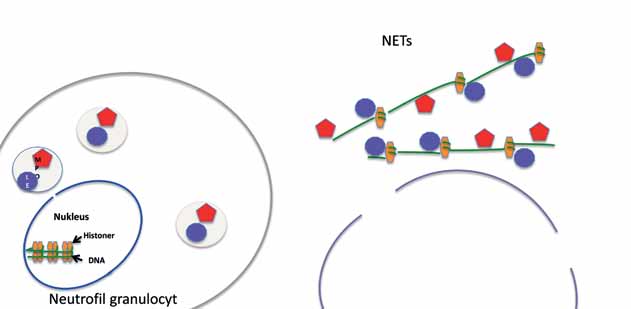
Bild 4. Schematisk bild av Neutrophil extracellular traps (NETs). Vid aktivering bildas NETs av extracellulärt DNA, histoner och granulaenzymer myeloperoxidas (MPO) och leukocytelastas (LE).
Forskargruppen och framtiden
Det finns stora utmaningar kvar när det gäller kunskap om och behandling av akut pankreatit. Vi kommer att fortsätta fokusera på effekterna av neutrofila granulocyter och NETs samt kopplingen mellan inflammation och koagulopati. Flera av dessa studier drivs av doktorand Erik Wetterholm och Martina Sjöbeck står i startgroparna för ta vid och fortsätta studera dessa mekanismer. När det gäller biomarkörer så innebär den nya Atlantaklassifikationen att det blir mer intressant att även skilja ut riktigt Stora Forskarpriset 2015 milda patienter, som inte ens drabbas av övergående, kortvarig organsvikt och som i framtiden skulle kunna vårdas polikliniskt. Dessa frågor kommer att analyseras vidare och vara en del i Hanna Sternbys avhandling. För att forskningen ska kunna bedrivas effektivt, växa och generera intressanta resultat behövs förutom doktorander och handledare en fungerande organisation. I vårt labb finns samma Anne- Marie som lärde mig grunderna i laboratoriearbete. Hon lär upp och visar nya doktorander till rätta, analyserar själv de viktigaste proverna och anpassar eller utvecklar metoder beroende på hur våra studier växer fram. Forskningssjuksköterska Ingrid Palmquist har kontroll på kliniska studier, inkluderade patienter och biobanker vilket är ett måste för att denna stora apparat ska fungera. Pernilla Siming är forskningsadministratör och dessutom behjälplig med alla arrangemang kring disputationer. Vi har givetvis också stort utbyte av kollegor och samarbetspartners i Malmö, Lund, resten av Sverige och Europa. Det finns ingen brist på uppslag till nya studier, snarare har musmodellerna möjliggjort analys av mekanismer som vi tidigare inte kunnat närma oss. I kombination med våra kliniska studier finns det goda möjligheter att överföra resultaten till de kliniska situationerna. Det är min övertygelse och stora förhoppning att resultaten ska kunna komma patienterna till godo inom en snar framtid.
