Klinisk nutrition
2016 – 03 – 01 / Svensk Kirurgi / Volym 74 / Nr 1 / 2016
Att sköta rondarbete på avdelningen är en av de första uppgifter en underläkare i kirurgi får. En helt central del i det arbetet är att för varje patient ta ställning till optimal strategi för nutrition den aktuella dagen. Många gånger fattas beslut på svaga grunder, kanske genom att se vad som stod på dropplistan föregående dag. De flesta patienter kan snart återgå till normalt födointag varefter tilläggsnutrition minskar i betydelse men det finns ändå stor förbättringspotential i denna del av omhändertagandet av våra patienter.
Nu efter jul- och nyårshelgerna kan det vara på sin plats att ta upp frågan om nutrition (den kliniska nutritionen).
Bakgrund
I modern tid har många kirurger varit starkt bidragande till utvecklingen av den kliniska nutritionen. Sir Francis Moore och John Kinney beskrev på 60-talet patientens påverkan av kirurgisk stress, trauma och inflammation vilket är en viktig utgångspunkt vid nutritionsbehandling(1,2). Betydande svenska bidrag till utvecklingen av den parenterala nutritionen gjordes av Arvid Wretlind, biokemist, och Erik Vinnars, anestesiolog. På senare delen av 70-talet utvecklade Claude Solassol konceptet med all-in-one-bag, storpåsen, som i dagens sjukvård ses som en självklarhet vid nutritionsbehandling, men som i sig var en farmaceutisk utmaning att utveckla och som ersatte ”fler-flaskesystemet – en vit – en klar – och en gul”.
Nutritionsforskningen är ett fält som är svårstuderat och resultaten är ibland dessutom svårtolkade. Klassiskt har nutritionsforskningen haft problem med för små och inte alltid väldesignade studier med svag power.
Mellan USA och Europa har det historiskt varit skillnader på behandlingsprinciper inom klinisk nutrition. Arvid Wretlind lyckades framställa en lipidlösning baserad på sojabönolja vilken möjliggjorde en mer balanserad parenteral nutrition där en stor del av energin gavs som fett.
I USA baserades lipidlösningarna på bomullsfröolja som hade biverkningar och toxicitet vilket gjorde att konceptet hyperalimentation med stora mängder glukos i lösningarna; principen the-more-the-better infördes. Denna obalanserade och ofysiologiska form av ”nutrition” medförde att den parenterala nutritionen i USA blev förknippad med mycket biverkningar, vilka man med dagens kunskap kan förklara. Parenteral nutrition ck ett negativt rykte, och nutritionsbehandlingen kom att baseras med större tyngpunkt på enterala lösningar. Denna skillnad mellan koncept kom att påverka nutritionsvetenskap, diskussioner och praktiskt genomförande under 70- och 80-talet där ett läger ”enteralisterna” talade för enteral nutrition och ”parenteralisterna” för parenteral nutrition. Man kunde läsa publikationer som Death by parenteral nutrition – TPN (Total Poisonous Nutrition)(3) och man ägnade energin till att bevisa och motbevisa vilken modalitet som var bäst. För mer detaljer kring nutritionshistorien sett även ur ett längre perspektiv fram till år 2000 hänvisas till en artikel av Erik Vinnars(4).
Nu har synen på nutritionsbehandling blivit mer balanserad och man ser fördelarna med de olika nutritionsmetoderna, gärna i kombination, beroende på den kliniska situationen.
Modern kirurgisk perioperativ vård med ERAS (Enhanced Recovery After Surgery) infört av kirurgkolle- gorna Olle Ljungqvist, Ken Fearon, Henrik Kehlet, Cornelis Dejong och Arthur Revhaug har inneburit att patienter, även de som genomgår omfattande kirurgi, i större utsträckning med spontant födointag tidigt täcker sitt näringsbehov(5). ERAS och ERP (Enhanced Recovery Programme) har nu blivit en realitet inom den perioperativa vården(6).
Sjukdom, operation och trauma
Kirurgiska patienter har ofta ett minskat födointag, en ökad stress- och många gånger ett in ammationspåslag som bidrar till katabolism (nedbrytning av kroppsmassa). Den ofrivilliga viktsnedgången är ett tecken på en katabol situation. För den enskilda patienten kan orsaken vara olika beroende på kirurgisk orsak, såsom sjukdom i GI-kanalen, försämrat näringsupptag, cancersjukdom, kronisk eller akut in ammatorisk sjukdom och åldrande (Figur 1). Påverkan av sjukdom är multifaktoriell med minskat nutritionsintag i kombination med ett ökat stress- och in ammatoriskt påslag. Nedbrytning av kroppsmassa och framför allt protein (lean-body-mass) orsakad av ett akut eller kroniskt in ammationspåslag, cachexi, är svårbehandlat nutritionsmässigt om inte grundorsaken också behandlas, medan viktsminskning beroende på bristande näringsintag är lättare att behandla. Patienter med cachexi och ofrivillig viktsnedgång har en systempåverkan av sjukdomen vilket i sig är en riskfaktor som man bör ta med i planering inför kirurgisk åtgärd och vård. Vid svårare akut katabolism förlorar patienten snabbt vikt och lean-body mass (protein) medan återhämtningen ofta tar längre tid (Figur 2).
Ju mer komplex en kirurgisk situation är desto större påverkan finns också ur nutritionssynpunkt. Kirurgiska patienter, antingen elektiva eller akuta med malnutrition och ökad nutritionsrisk har en försämrad sårläkningsförmåga, ökad risk för anastomosinsuffciens, minskad immunokompetens med ökad risk för framförallt svampinfektioner, minskad muskelkraft, ork och en sämre prognos(7). Kirurgisk sjukdom, behandling och in ammationspåslag ökar ytterligare katabolismen. En kirurgisk komplikation som är relaterad till malnutrition tar ofta lång tid att behandla och är dyrbar både för sjukvård och patient.
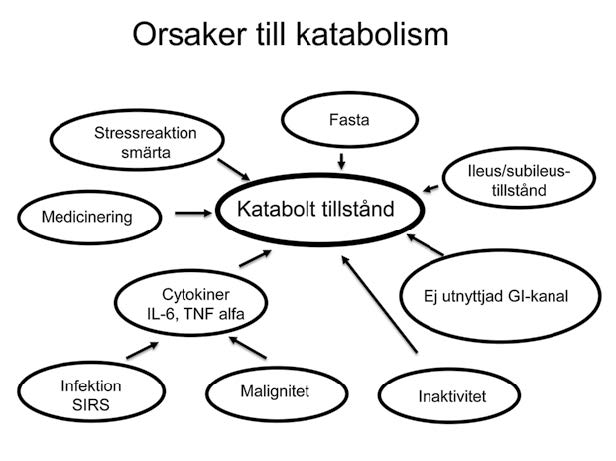
Figur 1. Orsakerna vid katabola tillstånd är många och ofta är det era i kombination, mer eller mindre uttalat för den enskilda patienten.
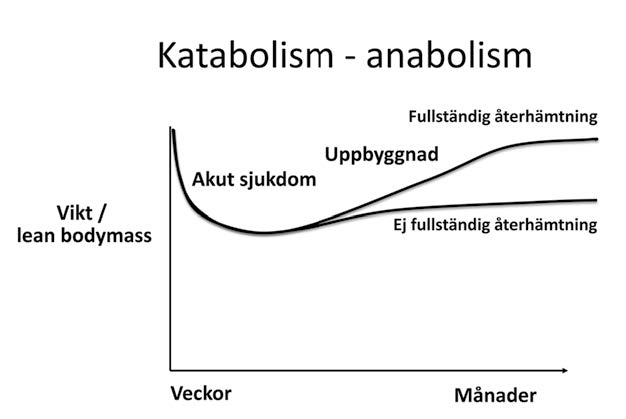
Figur 2. Vid akut sjukdom med svårt katabolt påslag förloras lean-body-mass (protein) snabbt och vikten minskar, återuppbyggnaden tar betydligt längre tid och är beroende av patient- och sjukdomsfaktorer.
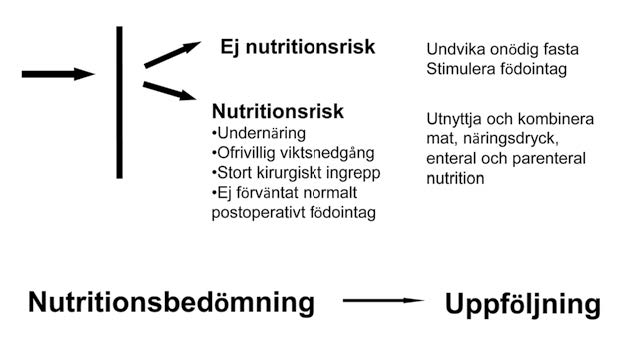
Figur 3. Bedömning om en patient har en nutritionsrisk eller inte är viktig för den fortsatta behandlingen. Enkla principer tillämpas och olika delar kombineras beroende på patientens behov.
Även om nutritionsbehandling inte alltid kan motverka katabolismen, orsakad av metabol påverkan, ålder och sjuklighet, är dess effekt åtminstone att begränsa förluster och att förbättra funktion. Att vända ett katabolt förlopp förutsätter att orsaken till katabolismen elimineras eller reduceras och när det gäller muskelmassa att muskulaturen belastas. Att återskapa förlorad leanbody-mass eller att återfå en normal kroppssammansättning kan ta väldigt lång tid i relation till hur snabbt den går förlorad och i allmänhet är det fettmassa som patienten bygger på sig till en början.
Framför allt inom den elektiva och akuta GI kirurgin är det vanligt med nutritionsrelaterad problematik, men det förekommer också inom andra kirurgiska specialiteter, till exempel inom kärlkirurgi med en dominans av äldre patienter.
Ju sjukare en patient är desto mer framträdande är nutritionsproblematiken. Långt framskriden svår sjukdom innebär ofta ett behov av nutritionsbehandling där det till slut blir en etisk fråga om att sätta in behandling alternativt avsluta behandling. Vid avancerad terminal sjukdom bör nutritionsbehandling avslutas då näringsbehandling inte förlänger livet eller förbättrar livskvaliteten. Parenteral nutrition vid avancerad sjukdom kan leda till ökad vätskeretention och metabola komplikationer då substrat inte längre omsätts och metaboliseras normalt.
Kunskap om nutrition och nutritionsrutiner är därför viktigt för kirurgen och den kirurgiska verksamheten. Faran med att inte agera eller ta ställning till en patients nutritionsproblem är att tiden lätt rinner iväg och att patienten riskerar att komma i en sämre situation. Ofta missas malnutritionsdiagnosen hos patienter och långt ifrån alla har en acceptabel nutritionsbehandling(8).
En berättigad fråga är vilken utbildning och vilket intresse har vi kirurger i området egentligen?
Vad är nutritionsbehandling?
Nutritionsbehandling består av olika delar, allt från ätstödjande åtgärder, kost- och näringstillskott, till enteral och parenteral nutrition. Grunden bör alltid vara en bedömning av näringsbehov och en nutritionsregistrering så att energibalansen kan bedömas. Beroende på den kliniska situationen kan de olika delarna kombineras. Man bör alltid utgå från att om möjligt ge en viss del nutrition oralt, enteralt, det vill säga i magtarmkanalen (Figur 3).
Nutritionsstatus och nutritionsrisk
I den kliniska rutinen bör man ha ett screeningförfarande för att tidigt identifiera patienter med nutritionsrisk. Enkla frågor om patienten håller en stabil vikt (ofrivillig viktsnedgång?), kunnat äta normalt senaste tiden och en bedömning av BMI ingår i de flesta screeningverktyg. Patientens aktuella sjukdom bör även tas med i bedömningen. I screening- verktygen ingår i allmänhet inte uppgifter om patientens allmänna ork, men frågor kring muskelkraft och ork är väsentliga. Allmänt vedertagna screeningverktyg är SGA (Subjective Global Assessment), MNA (Minimal Nutritional Assessment, validerad för äldre patienter), NRS-2002 (Nutritional Risk Screening) som är mer eller mindre omfattande. SKL ́s definitioner är enkla och användbara och består av följande frågor9:
- Har du minskat i vikt (ofrivilligt)?
- Kan du äta som vanligt?
- <70 år med BMI <20 = underviktig,
>70 år med BMI <22 = underviktig
• Ingen riskfaktor = Välnärd
• En riskfaktor = Risk för undernäring
• två eller tre riskfaktorer = Stor risk för undernäring
I den kliniska verksamheten är det viktigt att använda bra rutiner och enkla metoder för bedömning av näringsstatus och nutritionsrisk. Denna bedömning bör göras i samband med inläggning eller mottagningsbesök om patienten ska genomgå en kirurgisk behandling. I allmänhet är det sköterskans uppgift att vid inskrivning göra bedömningen. För inneliggande patienter bör man vid ronden bedöma om patienten har en ökad nutritionsrisk, hur patienten nutrieras, energibalans och hur den aktuella trenden i förhållande till buksymtom ser ut. För patienter med nutritionsproblem behöver man skissa på en behandling som sträcker åtminstone ett antal dagar framöver.
Nutritionsbehandling och strategi
Nutritionsterapi baseras på alltifrån ätstödjande behandling, kosttillskott, näringsdrycker till enteral och parenteral nutrition. Inte sällan är det möjligt med kombinationer. Man bör utgå från att om möjligt tillföra näring i GI-kanalen ”den naturliga vägen” genom oral eller enteral tillförsel(10). Nutritionsbehandling ges när patienten inte spontant täcker sitt näringsbehov och tidpunkten avgörs av klinisk situation och av patientens nutritionsrisk. Patientens näringsbehov uppskattas och energibalans beräknas.
Det bör finnas en något långsiktig plan för nutritionsbehandling, åtminstone för ett antal dagar framåt där behandlingen avgörs av det kliniska förloppet, buksymtom och av patientens spontana födointag.
När nutritionsbehandling sätts in bör man ha en plan för denna och även ett tidsperspektiv. Ofta behöver näringsbehandling ges under en något längre period, era dagar och dagligen utvärderas. I monitorering ingår beräkning av energibalans, labstatus, temperatur och bedömning av kliniska symtom. Nutritionsbehandling, framför allt enteral och parenteral kan i sig medföra komplikationer som är viktiga att känna till, undvika eller identifiera om de inträffar. Vid inledning av nutritionsbehandling kan det vara en god regel att starta med en lägre dos för att senare trappa upp. Om det är ett långsiktigt behov är det viktigt att täcka näringsbehovet helt men vid ett kortvarigare behov kan man ge behandling som delvis täcker. Vid avslutande av nutritionsbehandling bör man samtidigt göra en bedömning av det spontana näringsintaget, antingen genom att uppskatta det eller mäta.
Vem ska ha nutritionsbehandling?
Patienter med nutritionsrisk i samband med kirurgisk vård, det vill säga de med malnutrition, de som genom- går avancerad behandling, eventuellt i kombination med cytostatika, vilket erfarenhetsmässigt leder till nutritionsproblem, bör ges nutritionsbehandling tidigt under vårdförloppet. Valet avgörs av den kliniska bilden, av buksymtom och i vilken utsträckning patienten själv kan ”försörja sig per os”. Patienter som från början inte har en ökad nutritionsrisk men som i samband med kirurgisk sjukdom och vård inte kan äta, eller inte kommer upp i adekvat energibalans bör ges nutritionsbehandling med början efter tre–fem dagar. Tidpunkten avgörs av klinisk bild och förlopp. Tidpunkten vilar egentligen inte på någon vetenskaplig grund men har blivit en allmänt accepterad tumregel.
Kirurgiska myter kring nutrition
”Ta bort nutritionen så blir patienten hungrig.” tanken är ju god, men fung- erar inte i alla situationer. Det viktiga när nutritionsbehandling avslutas är att den trappas ut samtidigt som man mäter patientens nutritionsintag.
”Nutrition kan bidra till att göda tumören hos cancerpatienter.” Detta är en hypotetisk fråga, men den allmänt accepterade inställningen är att en patients förmåga att klara av en onkologisk behandling och tumöroperation är att patientens nutritionstillstånd optimeras.
Finns det er myter – eller frågor, kommunicera gärna dessa!
Referenser
1. Moore FD. Bodily changes in surgical convalescence. Annals of surgery. 1953;137:289-315.
2. Kinney JM, Long CL, Gump FE, Duke JH. tissue composition of weight loss in surgical patients: elective operation. Annals of surgery. 1968;168:459-74.
3. Marik PE, Pinsky M. Death by parenteral nutrition. Intensive care medicine. 2003;29:867-9.
4. Vinnars E, Hammarqvist F. 25th Arvid Wretlind’s Lecture–Silver anniversary, 25 years with ESPEN, the history of nutri- tion. Clin Nutr. 2004;23(5):955-62. Epub 2004/09/24.
5. Fearon KC, Ljungqvist O, Von Meyen- feldt M, Revhaug A, Dejong C, Lassen K, et al. Enhanced recovery after surgery: A consensus review of clinical care for patients undergoing colonic resection. Clin Nutr. 2005;24:466-77.
6. Ljungqvist O. ERAS – Enhanced Recovery After Surgery: Moving Evidence-Based Perioperative Care to Practise. JPEN Jour- nal of parenteral and enteral nutrition. 2014;38:559-66.
7. Norman K, Pichard C, Lochs H, Pirlich M. Prognostic impact of disease-related malnutrition. Clin Nutr. 2008;27(1):5- 15. Epub 2007/12/07.
8. Kondrup J, Johansen N, Plum LM, Bak L, Larsen IH, Martinsen A, et al. Inci- dence of nutritional risk and causes of inadequate nutritional care in hospitals. Clin Nutr. 2002;21(6):461-8.
9. SKL. Undernäring – åtgärder för att förebygga. Sveriges Kommuner och Landsting. 2011.
10. Hammarqvist F. Can it all be done by enteral nutrition? Current opinion in clinical nutrition and metabolic care. 2004;7:183-7.
FOLKE HAMMARQVIST
folke.hammarqvist@karolinska.se
Stockholm

