Prisbelönt ST-arbete – Råd vid övre GI-blödning
2015-02-04 / Svensk Kirurgi / Volym 73 / Nr 6 / 2015
Kommittén för klinisk forskning har under 2015 belönat de två bästa vetenskapliga ST-arbetena med 5000 kr. I detta nummer presenteras det första som avhandlar en vanlig patientgrupp med övre GI-blödning. Fokus ligger på en jämförelse mellan endovaskulär och kirurgisk behandling av endoskopirefraktära övre GI-blödningar och resultaten efter respektive åtgärd i Malmö. Även om genomgången är retrospektiv, var grupperna som gick till endovaskulär terapi och öppen kirurgi jämförbara vid baseline och det gör resultaten extra intressanta.

Bianca Ottochian
bianca.ottochian@skane.se
Malmö
Övre gastrointestinal (GI-) blödning, det vill säga en blödning proximalt om Treitz ligament har en incidens på 125/100000 invånare per år i Västeuropa med stor nationell variation(1). I Sverige beräknades incidensen till 38/100000 invånare per år 2005(1). Den vanligaste anledningen till en övre GI-blödning är ulcus i ventrikeln eller duodenum. Andra orsaker är tumörer, kärlmissbildningar, Mallory-Weissrift, ischemi, gastrit med flera(2-6). Även om incidensen ulcuspatienter minskar, framför allt sedan tillkomsten av protonpumpshämmare och introduktionen av antibiotikabehandling vid Helicobacter Pylori infektion, är morbiditeten samt mortaliteten vid en övre GI-blödning oförändrad i den äldre befolkningsgruppen13. Detta beror troligtvis på att vi har en åldrande befolkning med flera riskfaktorer och en ökad användning av acetylsalicylsyra samt NSAID(4) .
Övre GI-blödning har idag en mortalitet på sex–tio procent(11). Ofta är patienterna äldre och multisjuka vilket kan förklara den höga mortaliteten. Före endoskopins era behövde 35–55 procent av patienterna med massiv övre GI-blödning åtgärdas med akut kirurgi, med en mortalitet på 20–50 procent(12). Akut endoskopi för att diagnostisera blödningskällan och åtgärda densamma är golden standard vid behandling av blödande ulcus(7-9). Sedan endoskopins tillkomst har behovet av akut kirurgi minskat till cirka fem procent, det vill säga för de patienter som har en massiv blödning eller fortsätter blöda trots endoskopisk åtgärd(10). Mortaliteten för denna grupp ligger dock fortfarande på 10–50 procent. Flertalet studier har identifierat följande riskfaktorer för reblödning(4,9-10,16):
• Ålder över 60
• Hög komorbiditet, fram för allt hjärt/kärlsjukdom
• Större primärblödning
• Aktiv blödning vid endoskopi, det vill säga Forrest klass I-IIa
• Ulkus lokaliserade i bulbens posteriora del eller på ventrikelns minorsida.
Ett alternativ till kirurgisk intervention är transarteriell embolisering TAE(11-23). Fördelen med denna behandling är att bespara äldre och multisjuka patienter stor, öppen kirurgi. Studier från bland annat Uppsala där man retrospektivt jämfört behandlingsresultaten av TAE och kirurgi vid övre GI-blödningar som inte kunnat åtgärdas endoskopiskt har kunnat visa att TAE är en lika effektiv behandlingsmetod som öppen kirurgi vid blödning, men behäftad med färre komplikationer såsom läckage med abscessbildning, sårinfektion/sårruptur eller multiorgan svikt(14). En del studier har även kunnat påvisa en något lägre mortalitet i den patientgrupp som åtgärdats med TAE, detta trots att denna patientgrupp både var äldre och hade högre komorbiditet än den patientgrupp som genomgick kirurgisk intervention(14). De flesta studier har dock inte kunnat påvisa någon statistiskt signifikant skillnad i mortalitet mellan grupperna, men patientgruppen som genomgått TAE har varit äldre och haft högre komorbiditet än den patientgrupp som genomgått öppen kirurgi vilket innebär att TAE är ett minst likvärdigt alternativ till öppen kirurgi vid endoskopiresistent blödning(11-12,16-21).
För en patient som idag vårdas inneliggande för en endoskopiskt verifierad terapiresistent övre GIblödning vid SUS Malmö finns det ingen konsensus avseende vilken behandlingsmetod som ska väljas för definitiv terapi. Beslutet är helt beroende på jourhavande kirurg samt tillgång till angiokompetens. Syftet med detta arbete var att göra en deskriptiv populationsstudie av de patienter som behandlats med TAE alternativt öppen kirurgi vid övre GI-blödning där endoskopisk terapi misslyckats, samt att jämföra våra resultat med de resultat man fått fram i tidigare studier(11-21).
Material och metoder
Från januari 2009 till december 2012 lades 879 patienter in på SUS Malmö på grund av en övre GI-blödning. Utav dessa patienter gastroskoperades 566, varav 149 åtgärdades endoskopiskt med injektionsbehandling, clips och/eller koagulationsbehandling. Tjugonio patienter (3,3 %) blödde för profust för att åtgärdas endoskopiskt eller reblödde trots endoskopisk åtgärd (figur 1). Utav dessa genomgick 16 patienter TAE och 13 patienter öppen kirurgi (tabell 1).
En patient som inkom med övre GI-blödning visade sig vid gastroskopin ha ett inklämt hiatushernia som åtgärdades laparaskopiskt subakut ett par dagar efter diagnos. Då denna patient inte krävde kirurgi på grund av blödning har vi valt att inte inkludera denna patient i studien. Fyra patienter visade sig ha fri gas på CT och gick därför direkt till kirurgi utan föregående endoskopi. Då dessa patienters huvudsakliga problem inte var blödning utan perforation exkluderades även de ur studien. Studien inkluderar inte patienter med blödning från esophagusvaricer eller blödning distalt om Treitz ligament. Kontrollgastroskopi planerades inte som regel, men förekom hos patienter med tecken på fortsatt blödning såsom melena eller hematemes alternativt sjunkande Hb.
Valet av behandlingsmetod baserades på patientens aktuella status, komorbiditet samt tillgänglighet till endovaskulär operationssal inom rimlig tid. I kirurgigruppen var fördelningen män/kvinnor inte jämn då 10 av 13 patienter var män. Om detta var en ren tillfällighet eller om man var mer restriktiv med att operera kvinnor framkommer inte av vårt underlag. Från patienternas journaler i Melior, Kundrad, Orbit samt Sectra noterades följande variabler för varje patient: patientens ålder och kön, komorbiditet/ASA-klass, endoskopisk diagnos och behandling, blodtryck och puls vid inkomst, lägsta Hb-värde och eventuellt transfusionsbehov före och efter behandling, utförd behandlingsmetod, diagnos vid behandling, komplikationer efter behandling, behov av ytterligare behandling efter utförd åtgärd (TAE alternativt kirurgi), vårdtid, akut mortalitet och 30-dagars mortalitet. Alla patienter behandlades med protonpumpshämmare enligt gängse rutin.


Angiografi och transarteriell embolisering
Då detta är en retrospektiv studie fanns ingen standardiserad metod för den endovaskulära åtgärden(25). Alla endovaskulära ingrepp utfördes på SUS Malmö av en specialist i endovaskulär kirurgi (åtta olika läkare utförde de 16 ingreppen). Hos 15 patienter fick man access via a. femoralis och hos en patient gick man in via a. brachialis. Kateterstorleken var som regel 6–7 French. Försök till superselektiv embolisering gjordes vid påvisbar pågående extravasering. Då ingen extravasering kunde identifieras vid angiografin emboliserades a. gastroduodenale blint. Man använde sig av makro- respektive mikrocoils, Nestor coils från COOK eller retrievable coils från Terumo eller COOK.
Alla de 16 patienter som åtgärdades endovaskulärt coilades. Hos elva patienter kunde man se pågående extravasering vid angiografin. En patient erhöll även onyx och ytterligare två patienter erhöll även spongostan. Fjorton patienter coilades i a. gastroduodenale, varav en patient dessutom coilades i a. pancreatica inferior och a. gastroepiploica och en patient fick kompletterande coils i a. pancreaticoduodenalis. Två patienter coilades i a. hastrica sinistra. En patient förblödde under pågående endovaskulär behandling.
Kirurgi
Av de 13 patienter som genomgick kirurgisk intervention för sin GI-blödning laparatomerades alla. Sju patienter åtgärdades med duodenotomi, omstickning av a. gastroduodenale (GDA) och slutligen en duodenorafi. Två patienter gastrotomerades varefter man gjorde omstickning av GDA samt gastrorafi. Hos två patienter bedömdes bulbens bakvägg vara av så dålig kvalité att man valde att göra en Billroth II med gastro/ enteroanastomos (GE) och entero/ enteroanastomos (EA). En utav dessa patienter blev även transversumrecesserad då ulcuset eroderat ner mot colon transversum. En patient blev ventrikelexkluderad efter omstickning av GDA. Även denna patient erhöll en GE/EA samt en avlastande duodenostomi i kvarvarande duodenumstump. En patient avled på bordet på grund av profus blödning innan man hade hunnit åtgärda blödningskällan. En patient visade sig ha ett inklämt hiatus hernia med upsidedown ventrikel och åtgärdades med en laparoskopisk fundoplication och exkluderades därför. De fyra patienterna som exkluderats ur studien på grund av påvisad fri gas på CT hade alla ett perforerat ventrikelulcus och åtgärdades med gastrorafi. Statistiska metoder Som statistisk metod valde vi Mann Whitney’s test och Chi square-test. Mann Whitney’s test är ett icke parametriskt test som är lämpligt för att jämföra två grupper som kanske inte är normalfördelade. Testet tar hänsyn till icke-normalfördelade statistiska data såsom i ovanstående två grupper och ger svar på frågan om det finns någon skillnad mellan grupperna. Chi square-test jämför fördelningen av en variabel som mäts enligt nominalskalan och användes för att avgöra hur stor skillnaden mellan grupperna var avseende de variabler som bara hade två möjliga utfall såsom kön, medicinering, mortalitet etc. Ovanstående analyser gjordes i statistikprogrammet Prism 6.
Resultat
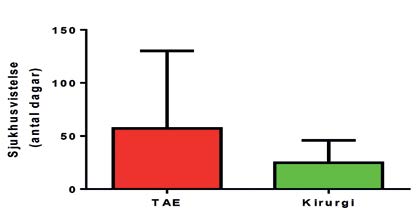
Duodenalulcus var den vanligaste orsaken till blödning med en frekvens på 87,5 procent i TAE-gruppen (14 patienter) samt 84,6 procent i kirurgigruppen (11 patienter). Patientgrupperna skilde sig inte åt avseende ålder, kön, ASA-klass eller medicinering som predisponerar för blödning. Grupperna var även snarlika avseende cirkulatorisk påverkan vid inkomst samt blödningens allvarlighetsgrad. Sjukhusvistelsen för TAE-gruppen var något längre (medel 57,1 dagar, range 3-237 dagar) än för kirurgi-gruppen (medel 24,8 dagar, range 1-70 dagar). Detta var dock inte statistiskt signifikant (p-värde = 0,36). Transfusionsbehovet innan åtgärd (TAE alternativt kirurgi) skilde sig inte heller åt mellan grupperna, TAE-gruppen krävde i snitt 12 E SAG, 4,5 E plasma samt 1,3 E trc, medan kirurgigruppen krävde 13,3 E SAG (p-värde = 0,43), 5,2 E plasma (p-värde = 0,29) samt 0,85 E trc (p-värde = 0,42). Efter åtgärd krävde TAE-gruppen i snitt 11,5 E SAG, 7,1 E plasma och 1,2 E trc medan kirurgigruppen endast krävde 4,5 E SAG (p-värde = 0,08), 5,8 E plasma (p-värde = 0,63) och 0,3 E trc (p-värde = 0,19). Inga av dessa värden utföll statistiskt signifikant.
Primär hemostas förekom hos sex av 16 patienter (37,5%) i TAEgruppen, och hos nio av 13 patienter (69,2%) i kirurgigruppen (p-värde = 0,09). Av de tio patienter som reblödde alternativt fortsatte blöda trots TAE avled en patient på angiografibordet på grund av okontrollerad blödning. Tre patienter kunde åtgärdas med gastroskopi alternativt slutade blöda spontant. En patient genomgick både angiografi och gastroskopi på grund av en ny melenaepisod utan att man kunde identifiera någon blödningskälla varför ingen ytterligare åtgärd utfördes. En patient genomgick en ny angiografi där man kunde påvisa extravasering från en GDA-gren som coilades samt onyx-behandlades. Två patienter laparatomerades på grund av blödning som inte kunde åtgärdas trots både endoskopisk och endovaskulär behandling. Hos en av dessa patienter ligerade man av GDA samt gjorde en Billroth II med GE och avlastande duodenostomi i duodenumstumpen. Postoperativt utvecklade denna patient en sårruptur samt en fistel från ventrikeln till sårhålan för vilket patienten reopererades ett flertal gånger. Den andre patienten hade ingen synlig extravasering vid angiografin men en profus blödning vid gastroskopi varför man valde att gå vidare med öppen kirurgi. Blödningen kunde åtgärdas med omstickning av GDA-grenar samt en duodenorafi. Postoperativt drabbades denna patient av flera sepsisepisoder, ischemisk cholecystit, pneumoni, cor inkomp och nutritionssvårigheter på grund av stenosutveckling i pylorus. Patienten erhöll slutligen en avlastande GE/EA. Två patienter med generaliserad cancer reblödde ett par dagar efter TAE men bedömdes ha för avancerad grundsjukdom för ytterligare åtgärder och avled på grund av sin blödning. Två patienter i TAE-gruppen drabbades av pancreatit och en patient fick en blödning vid insticksstället i a. brachialis, explorerades för utrymning av hematomet och genomgick en rafi av a. brachialis. Alla fem patienter som inte hade någon pågående extravasering vid primärangiografin och därför coilades blint reblödde eller fortsatte blöda efter åtgärd.
Av de fyra patienter som fortsatte blöda alternativt reblödde efter kirurgi behandlades en patient konservativt utan ytterligare blödning. En patient gastroskoperades utan att man kunde se någon blödningskälla varför ingen ytterligare åtgärd utfördes. Två patienter angiograferades, varav en patient hade pågående extravasering från GDA som coilades med gott resultat. Även den andra patienten hade påvisbar extravasering från GDA vilken coilades. Denna patient reblödde återigen varför man gjorde en ny gastroskopi som påvisade riklig blödning. Patienten reangiograferades och man såg en massiv extravasering från a. pancreatico duodenalis. Försök att coila gjordes men patienten avled på angiografibordet under pågående behandling. En patient reopererades på grund av sårruptur. Trettiodagars mortaliteten i TAEgruppen var fem av 16 (31,3%) och tre av 13 (23,1%) i kirurgigruppen (p-värde = 0,62). Två av de fem i TAE-gruppen hade en generaliserad tumörsjukdom och behandlades endast palliativt vid fortsatt blödning och avled således av sin blödning. Två patienter utvecklade aspirationspneumoni med multiorgansvikt som ledde till mors och en patient avled i leversvikt. I kirurgi-gruppen avled en patient på grund av fortsatt blödning, en avled på grund av respiratorisk insufficiens och en patient gick bort på grund av anuri.
Diskussion
Transarteriell embolisering är ett alternativ till öppen kirurgi vid endoskopiresistent blödning i övre gastrointestinalkanalen. Tidigare studier har kunnat påvisa att TAE har lika bra behandlingsresultat som kirurgi trots att TAE-gruppen ofta varit både äldre och haft högre komorbiditet än kirurgigruppen(11-23).
I vårt material har patientgrupperna varit snarlika och ingen skillnad avseende vare sig ålder eller komorbiditet har kunnat påvisas. Inte heller har vi kunnat påvisa någon skillnad på blödningens allvarlighetsgrad mellan grupperna eller på transfusionsbehovet innan åtgärd. TAE-gruppen har dock påvisat en klar trend att reblöda/fortsätta blöda i större utsträckning (62,5 %) (p-värde = 0,09) än kirurgigruppen (30,7%), vilket även transfusionsbehovet efter åtgärd talar för (p-värde = 0,08). Detta skiljer sig åt från en del tidigare studier som påvisat markant lägre reblödningsfrekvens på 10–35 procent i den patientgrupp som behandlats med TAE(10-11,13-14,16-17,19-20). En förklaring till att TAE-gruppen tenderade att reblöda mer frekvent än kirurgigruppen är att övre GI-blödningar ofta är intermittenta och vid avsaknad av extravasering vid angiografi som förekom hos 31,3 procent av våra patienter i TAE-gruppen, coilas GDA blint vilket kan leda till att man missar den egentliga blödningskällan.
TAE-gruppen hade en längre medelvårdtid på 57,1 dagar jämfört med kirurgigruppens 24,9 dagar, detta trots att ingen större skillnad i postoperativ komplikationsfrekvens kunde noteras mellan grupperna. TAE-specifika komplikationer såsom blödning vid insticksstället påvisades hos en patient (6,3 %)24. Postoperativa komplikationer såsom sårruptur och sepsis förekom hos tre patienter i kirurgigruppen (23,1 %). Sex patienter (37,5 %) i TAE-gruppen behövde genomgå någon form av kirurgisk intervention på grund av reblödning alternativt postoperativ komplikation jämfört med tre patienter (23,1 %) i kirurgigruppen.
Avseende mortaliteten kunde ingen större skillnad ses mellan grupperna med en total mortalitet i TAEgruppen på 37,5 procent och i kirurgigruppen på 30,8 procent vilket stämmer med tidigare publicerade studier inom området som påvisar en mortalitet på 10-50 procent12. Våra resultat talar för att TAEgruppen blött mer än kirurgigruppen efter åtgärd men att detta inte haft någon påverkan på mortaliteten eller morbiditeten. Det har dock bidragit till att patienterna i TAE-gruppen krävt större transfusionsvolymer postoperativt och kan förklara att patienterna i TAE-gruppen behövt vårdas längre tid på sjukhus än de patienter som genomgått öppen kirurgi. Dessa skillnader är dock ej statistiskt signifikanta. Vårt material var litet med endast 16 patienter i TAE-gruppen respektive 13 patienter i kirurgigruppen vilket kan ha bidragit till det statistiska utfallet. En annan svaghet med vår studie är att det är en retrospektiv icke randomiserad studie vilket kan leda till selektionsbias vid val av operativ åtgärd; TAE eller öppen kirurgi.
Figur 2

Figur 3

Referenser
1. www.internetmedicin.se
2. Stael von Holstein C. Blödande Ulcus. A Lindgren & Söner, Mölndal, 2003.
3. Åhsberg Kristina. Complications to Peptic Ulcer and Peptic Ulcer Surgery. Bulletin No. 137 from the Department of Surgery, Lunds University, Sweden.
4. Rockall T.A., Logan R.F.A., Devlin H.B., Northfield T.C., and the steering committee and members of the National Audit of Acute Upper Gastrointestinal Haemorrhage. Risk Assessment After Acute Upper Gastrointestinal Haemorrhage. Gut 1996; 38: 316-321.
5. Barkun A N, Bardou M, Kuipers E J, Sung J, Hunt R H, Martel M, Sinclair P. International Consensus Recommendations on the Management of Patients With Nonvariceal Upper Gastrointestinal Bleeding. Ann Intern Med. 2010; 152:101-113.
6. Aabakken L. Nonvariceal Upper Gastrointestinal Bleeding. Endoscopy 2005; 37 (3): 195-200.
7. Gralnek I M, Barkun A N, Bardou M. Management of Acute Bleeding from a Peptic Ulcer. N Engl J Med 2008; 359: 928-37.
8. Wang J, Bao Y-X, Bai M, Zhang Y-G, Xu W-D, Qi X-S. Restrictive vs Liberal Transfusion for Upper Gastrointestinal Bleeding: A Meta-analysis of Randomized Controlled Trials. World J Gastroenterol 2013 October 28; 19(40): 6919-6927.
9. Seewald S, Seitz U, Thonke F, Sriram P.V.J., He X.K., Soehendra N. Interventional endoscopic treatment of upper gastrointestinal bleeding-when, how, and how often. Langenbeck’s Arch Surg (2001) 386:88-97.
10. Schoenberg M. H. Surgical therapy for peptic ulcer and nonvariceal bleeding. Langenbeck’s Arch Surg (2001) 386:98-103.
11. Ljungdahl M, Eriksson L-G, Nyman R, Gustavsson S. Arterial Embolization in Management of Massive Bleeding from Gastric and Duodenal Ulcers. Eur J Surg 2002;168:384-390.
12. Ripoll C, Banares R, Beceiro I, Menchén P, Catalina M-V, Echenagusia A, Turegano F. Comparison of Transcatheter Arterial Embolization and Surgery for Treatment of Bleeding Peptic Ulcer after Endoscopic Treatment Failure. J Vasc Interv Radiol 2004;15:447-450.
13. Toyoda H, Nakano S, Takeda I, Kumada T, Sugiyama T, Osada S, Kiriyama S, Suga T. Transcatheter Arterial Embolization for Massive Bleeding from Duodenal Ulcers not Controlled by Endoscopic Hemostasis. Endoscopy 1995 May;27(4):304-7.
14. Eriksson L-G, Ljungdahl M, Sundbom M, Nyman R. Transcatheter Arterial Embolization versus Surgery in the Treatment of Upper Gastrointestinal Bleeding after Therapeutic Endoscopy Failure. J Vasc Interv Radiol 2008; 19:1413-1418.
15. Bendix Holme J, Tönner Nielsen D, Funch-Jensen P, Viborg Mortensen F. Transcatheter Arterial Embolization in Patients with Bleeding Duodenal Ulcer: An Alternative to Surgery. Acta Radiol 2006;47:244-247.
16. Loffroy R, Rao P, Ota S, De Lin M, Kwak B-K, Geschwind J-F. Embolization of Acute Nonvariceal Upper Gastrointestinal Hemorrhage Resistent to Endoscopic Treatment: Results and Predictors of Recurrent Bleeding. Cardiovasc Intervent Radiol (2010) 33:1088-1100.
17. Venclauskas L, Bratlie S-O, Zachrisson K, Maleckas A, Pundziuz J, Jönson C. Is Transcatheter Arterial Embolization a Safer Alternative Than Surgery When Endoscopic Therapy Fails in Bleeding Duodenal Ulcer? Scandinavian Journal of Gastroenterology, 2010; 45: 299-304.
18. Wong T.C.L., Wong K-T, Chiu P.W.Y., Teoh A.Y.B., Yu S.C.H., Au K.W.L., Lau J.Y.W. A Comparison of Angiographic Embolization with Surgery After Failed Endoscopic Hemostasis to Bleeding Peptic Ulcers. Gastrointestinal endoscopy, Volume 73, No. 5:2011.
19. Loffroy R, Guiu B. Role of Transcatheter Arterial Embolization for Massive Bleeding From Gastroduodenal Ulcers. World J Gastroenterol 2009; 15(47): 5889-5897.
20. Larssen L, Moger T, Björnbeth B.A., Lygren I, Klöw N-E. Transcatheter Arterial Embolization in the Management of Bleeding Duodenal Ulcers: A 5,5-Year Retrospective Study of Treatment and Outcome. Scandinavian Journal of Gastroenterology, 2008; 43: 217-222.
21. Defreyne L, Vanlangenhove P, De Vos M, Pattyn P, Van Maele G, Decruyenaere J, Troisi R, Kunnen M. Embolization as a First Approach with Endoscopically Unmanageable Acute Nonvariceal Gastrointestinal Hemorrhage. Radiology 2001; 218: 739-748.
22. Eriksson L-G, Sundbom M, Gustavsson S, Nyman R. Endoscopic Marking with a Metallic Clip Facilitates Transcatheter Arterial Embolization in Upper Peptic Ulcer Bleeding. J Vasc Interv Radiol 2006; 17:959-964.
23. Schenker M P, Duszak R, Soulen M C, Smith K P, Baum R A, Cope C, Freiman D B, Roberts D A, Shlansky-Goldberg R D. Upper Gastrointestinal Hemorrhage and Transcatheter Embolotherapy: Clinical and Technical Factors Impacting Success and Survival. J Vasc Interv Radiol 2001; 12:1263-1271.
24. Jacob E T, Shapira Z, Morag B, Rubenstein Z. Hepatic Infarction and Gallbladder Necrosis Complicating Arterial Embolization for Bleeding Duodenal Ulcer. Digestive Diseases and Sciences, Vol 24, No 6(June 1979). 25. Resch T A, Acosta S, Sonesson B. Endovascular Techniques in Acute Arterial Mesenteric Ischemia. 10.1053/J.semvascsurg. 2009. 12. 004.
